李 达 刚 等
从一个偶然的发现,探索出用金属高价盐类作催化剂,丰金属(Zn、Al、Mn、Fe)在常温下可分解水或重水制氢或氘的方法。以Mn/H2O/FeCl3三元体系为例简述如下:
取300毫升磨口锥形瓶一个,注入100毫升纯净水,称取锰粉1.2克投入锥形瓶中, 室温下观察瓶内无气泡产生. 另取100亳升试管一支, 投入催化剂5mmol, 加入50亳升纯净水. 在室温10-35`C条件下, 催化剂快速溶解得透明溶液. 观察试管中亦无气泡产生. 但是, 当将试管中溶液在室温下倒入上述錐形瓶, 即刻观察到有大量气泡发生。出口连接排水集气瓶用以收集生成的气体。用气相色谱分析证实生成的气体是氢气。用重水替换水同理可在常温下制取氘。制氢实验结果列于表1及图1。
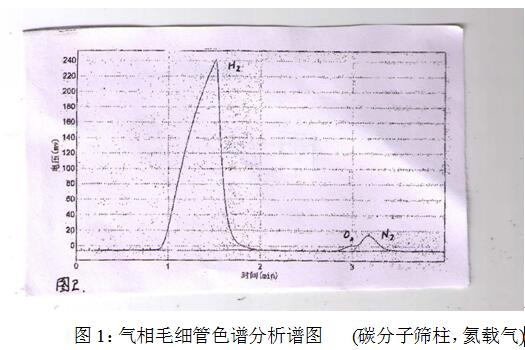
表1 Mn/H2O/催化剂三元体系产氢速率考察
======================================================================
No 三元体系 时间 温度 催化剂量 金属用量 H2O H2产量 H2产率 金属
(min) (`0C) (mmol) ( g ) (ml) (ml) (#) 转化率%
----------------------------------------------------------------------------------------------------------------------
1 Mn/H2O/催化剂 1 60 5.0 1.20 100/50 195 32.50 -
2 “ 2 60 5.0 1.20 100/50 225 18.75 45.01
3 “ 3 60 5.0 1.20 100/50 252 14.00 -
4 “ 4 60 5.0 1.20 100/50 267 11.13 53.43
5 “ 5 60 5.0 1.20 100/50 279 9.30 -
6 “ 6 60 5.0 1.20 100/50 287 7.97 57.42
7 “ 10 60 5.0 1.20 100/50 320 5.33 64.28
8 “ 18 60 5.0 1.20 100/50 352 6.26 -
9 “ 20 60 5 0 1.20 100/50 361 3.00 69.25
----------------------------------------------------------------------------------------------------------------------
由表1可见,反应2分钟金属锰的消耗率即达45.01% ,反应第一分钟氢气产率(#:每分钟 每克金属锰 每毫摩尔催化剂产出的氢气毫升数)是反应第10分钟的6倍。表明该常温分解水制氢法具有产氢的突发性并有更强的突发性待挖。用重水替代水可在常温下产出纯氘,且同样具有突发性。这种瞬间可集聚大量氢或氘的特性对於某此特殊场合是非常宝贵的。当前通常采用存贮高压液氢或超低温氢作为瞬间需要氢或氘的来源,如能采用夲发明之存储锰金属粉和制法简便,无毒无害,廉价易得的催化剂取而代之,显然,可克服易燃易爆及高能耗的弊端。夲发明与现有制氢或氘方法相比其优点在于:1)无需外加能源,可在10-600C下分解水或重水制得纯氢或纯氘。2)该制氢或氘方法具有突发性。即是在瞬间能集聚大量的氢或氘。3)全部原材料无毒,无害、无腐蚀性及均为安全稳定的物质。4)制法简单。5)不必用特殊制备的含氢或氘的易分解材料如硼氢化物或氘化锂等为原料。上述特点在科技上,可能会有潜在的应用价值,望合作深入挖掘。
联系人:李达刚 耄耋老创客。
原中国科学院兰州化物所研究员早己退休。
Email:dagangli36@163.com Tel:025-52662375